Termodinamiğin Kanunları

Termodinamiğin Kanunları genel kabul görmüş olup bilim insanları tarafından evrenin yasaları ismini almıştır. Termodinamiğin Kanunları 4 adet olup Termodinamiğin sıfırıncı kanunu, 1. kanunu, 2. kanunu ve 3. kanunu. Bu kanunlar ile enerji alanında ve uzay alanında büyük gelişmeler sağlanmıştır.
Termodinamiğin kanunları oldukça kapsamlıdır. Formülsel olarak basit olsa da kapsamları neticesinde oldukça geniştir. Herkesin anlayabileceği bir şekilde basit olarak bu kanunları açıklayalım.
Termodinamiğin Kanunları
Sıfırıncı Kanun
Termodinamiğin en basit kanunudur. Diğer kanunlardan sonra bulunduğu ve 1930’lu yıllara kadar belirtilmediği için Ralph Fowler bu kanunu sıfırıncı yani isimsiz kanun olarak belirtmiştir.
Sıfırıncı kanun bize ısıdaki dengeyi anlatır. Eğer iki sistem birbirleriyle etkileşim içerisindeyken aralarında ısı veya madde alışverişi olmuyorsa bu sistemler termodinamik dengededirler. Sıfırıncı kanun şöyle der:
Eğer A ve B sistemleri termodinamik dengedeyseler, ve B ve C sistemleri de termodinamik denge içerisindeyseler, A ve C sistemleri de termodinamik denge içerisindedirler.
Daha basit bir ifadeyle farklı sıcaklıklarda iki cisim ısıl bakımdan temas ederse sıcak olan cisim soğur, soğuk olan cisim ısınır. İşin temelinde, iki farklı sıcaklığa sahip iki cisim arasında gerçekleşen ısı akışının sıcak cisimden soğuk cisme gerçekleştiği gerçeği yatar, bazı soğuk cisimlerin sıcak, ya da bazı sıcak cisimlerin soğuk algılanması mümkündür. –30 derece soğuk olarak düşünülebilirse de –50 dereceye göre daha sıcaktır. Isı akışının soğuktan sıcağa doğru olmayışının temeli şudur: sıcaklık, malzeme atomlarının, daha doğrusu elektronlarının kinetik enerjisine etki eden bir faktördür. Elektronlar her zaman temel enerji seviyesinde olacak şekilde davranış gösterirler. Fazla kinetik enerjilerini aktarmak ve temel enerji seviyesine dönmek isterler. Sıcaklık, malzeme içinde atomların titreşmesi ile iletilir. Bu nedenledir ki, ısı akışı sıcak cisimden soğuk cisime doğru gerçekleşir.
1931 yılında Ralph H. Fowler tarafından tanımlanan bu yasa, temel bir fizik ilkesi olarak karşımıza çıktığından, doğal olarak 1. ve 2. yasalardan önce gelmek zorunluluğu doğmuş ve sıfırıncı yasa adını almıştır.
Termodinamiğin Birinci Kanunu
Bir sistemin iç enerjisindeki artış: sisteme verilen ısı ile, sistemin çevresine uyguladığı iş arasındaki farktır. Birinci kanuna göre bir sistemdeki toplam enerji sayısı sabittir lakin enerjinin türleri arasında etkileşim olur. Ayrıca bir sistemdeki enerji kesinlikle hem yok edilemez hem de yoktan var edilemez.
Bu yasa “enerjinin korunumu” olarak da bilinir. Enerji yoktan var edilemez ve yok edilemez sadece bir şekilden diğerine dönüşür. Bir sistemin herhangi bir çevrimi için çevrim sırasında ısı alışverişi ile iş alışverişi aynı birim sisteminde birbirlerine eşit farklı birim sistemlerinde ise birbirlerine orantılı olmak zorundadır. Bu ifadelerin yapılan deneylerle doğruluğu gözlenmiştir fakat ispat edilememektedir. Bütün bu ifadeler matematiksel olarak çok daha kolay ifade edilebilir.
Örnek; Bir pompa ve futbol topu düşünelim. Bu bir sistemdir. Şayet bir süre topu şişirirseniz pompanın ısındığını fark edeceksiniz. Bunun sebebi ise yaptığımız iş yüzünden pompa sistemindeki iç enerjinin yoğunlaşarak artmasından kaynaklanıyor. Sibobu topun deliğine sokup tutan arkadaşımız elinde bir sıcaklık hissettiğinde ise enerjiler etkileşime geçerek ısıyı havaya iletmiştir.
Formül: -Q + W = U1 – U2 (Q= ortaya çıkan enerji | W= yaptığımız iş | U= pompanın içindeki iç enerji)
Tipik bir termodinamik sistem: ısı sıcak kaynatıcıdan soğuk yoğunlaştırıcıya doğru hareket eder ve bu sayede bir iş ortaya çıkar.
Sistemin herhangi bir hal değişimindeki enerjisi de;
Q1-2 – W1-2 = E2 – E1 = (U2 – U1) + (1/2) m (V22 – V12) + m g (z2 – z1)
U: iç enerji
m: kütle
V: hız
g: yerçekimi ivmesi
z: yükseklik
Termodinamiğin İkinci Kanunu
Birçok alanda uygulanabilen ikinci kanunu termodinamiğin kanunları arasındaki en karmaşık kanundur. Basit olarak açıklamak gerekir ise enerjinin işe dönüşebilmesidir.. Yani nasıl ki arabalardaki motorlar benzin veya gaz yakarak enerjiyi itici güç haline dönüştürürler ve arabalar da bu güç sayesinde gider, işte bunu termodinamiğin 2. kanununu açıklar.
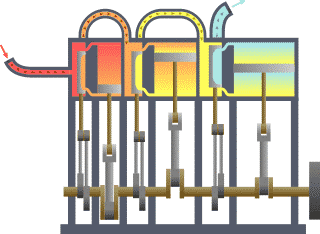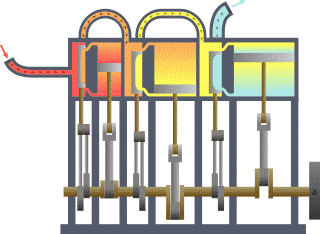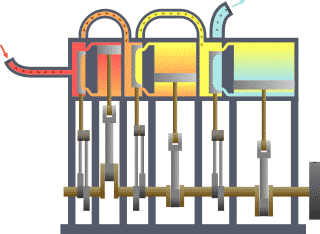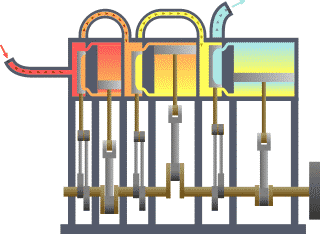
Bir ısı kaynağından ısı çekip buna eşit miktarda iş yapan ve başka hiçbir sonucu olmayan bir döngü elde etmek imkânsızdır. (Kelvin-Planck Bildirisi) ya da Soğuk bir cisimden sıcak bir cisme ısı akışı dışında bir etkisi olmayan bir işlem elde etmek imkânsızdır. (Clausius Bildirisi)
Termal olarak izole edilmiş büyük bir sistemin entropisi hiçbir zaman azalmaz. Ancak mikroskopik bir sistem, yasanın dediğinin tersine entropi dalgalanmaları yaşayabilir. Aslında, dalgalanma teoreminin zamana göre tersinebilir dinamik ve nedensellik ilkesinden çıkan matematiksel kanıtı ikinci yasanın bir kanıtını oluşturur. Mantıksal bakımdan ikinci yasa bu şekilde aslında fiziğin bir yasasından ziyade göreli olarak büyük sistemler ve uzun zamanlar için geçerli bir teoremi haline gelir. Ludwig Boltzmann tarafından tanımlanmıştır.
Sisteme dışardan enerji verilmediği sürece düzenin düzensizliğe düzensizliğin de kaosa dönüşeceğini anlatır. Kırık bir bardağın durup dururken veya kırarken harcanan enerjiden daha azı kullanılarak eski haline döndürülemeyeceği örneği verilir klasik olarak. Yine aynı şekilde devrilen bir kitabı düzeltmek için devirirken harcanan enerjiden fazlasını kullanmak gerekir, potansiyel enerjinin bir kısmı ısıya dönüşmüştür ve geri getirilemez. Aynı zamanda evrendeki düzensizlik eğilimini de anlatır. Düzensizlik eğilimini anlatırken entropi kelimesini kullanır. Yunanca, en = ingilizcedeki ‘in’ gibidir, önüne geldiği kelimeye -de, -da eki verir ve tropos = yol kelimesinin çoğulu olan ‘tropoi’ (tropi diye telaffuz edilir) kelimesinden. Yani; “yolda”).
Düzensizlik ya değişmez ya da artar. Örnek olarak difüzyon verilebilir. Ayrı duran maddeler bir arada olandan daha düzenlidir ve kendiliğinden karışmış sıcak ve soğuk sudan olmuşmuş ılık suyun, bir daha sıcak ve soğuk diye ayrılması imkânsızdır.
Eskime, yaşlanma, yıllanma gibi eylemlerin nedenidir.
En düzensiz enerji ısıdır ve bir gün gelecek bütün enerji ısı olacaktır ve bu da evrenin sonu demektir.
İleri sürülecek teoriler termodinamiğin 2. kanunuyla çelişmemelidir.
Entropi iş yapma yeteneği olmayan enerji olarak da tanımlanır. İki cam balona farklı sıcaklıklarda gaz, cam balonlar arasına da bir pervane konacak olursa ilk başta pervanenin döndüğünü görülecektir. Fakat sonra entropi arttığı için pervanenin dönmesi duracaktır.
Spor yapmak için bir parkta 100 metrelik bir koşu yapıldığını, 100 metrenin sonunda yorulup koşamayacak hale gelindiğini ve bir yere oturulduğu düşünülecek olursa koşarken harcanmış olan ve bir daha kazanılamayacak olan enerjiye entropi denir.
Bu olaya parantez açan ikinci yasa, hiçbir ısı enerjisinin tamamının işe dönüşmeyeceğini söyler. Yani araba alırken satıcı size 10 litre depo ile 10 km yol gidebilirsiniz derse bu ortalama 7-8 km yol demektir. Çünkü yasaya göre enerji hiçbir sistemi tam verimli çalıştıramaz. Bunun sebebi ise enerjinin işe çevrildiği süre boyunca içerideki sıcak enerji ile egzozdan giren soğuk enerjinin birbirleriyle olan etkileşiminden kaynaklanıyor. Yine yasaya göre enerji ters döngüye girdiği zaman kendi veriminde çalışabilir. Buna da Carnot prensibi deniliyor.
Carnot Prensibi
- Tersine çevrilebilen döngü, tersine çevrilemeyen döngüden daha verimlidir.
- Aynı kaynak sıcaklığında işleyen döngüler aynı verimliliğe sahiptirler.
Bu da şu demek oluyor; şayet evinizdeki klimayı 1 ay boyunca her gün 18 derecede çalıştırırsanız, yine 1 ay boyunca her gün 20 derecede çalıştırdığınızdan daha fazla elektrik faturası ödersiniz. Yani klimanızı 20 derecede çalıştırmak, 18 derecede çalıştırmaktan daha az masraflı.
Bunun sebebi ise klima içerideki sıcak havayı alarak dışarıya veriyor ve doğanın yani evrenin dengesini bozuyor. Ama dışarıdaki soğuk havayı da alarak içeri veriyor ve bir carnot prensibi döngüsü oluşturuyor. Bu olaya da entropi deniliyor. Düzensizliğin ölçüsü entropi ile tanımlanıyor.
Termodinamiğin Üçüncü Kanunu

Bu kanun neden bir maddeyi mutlak sıfıra kadar soğutmanın imkânsız olduğunu belirtir:
Sıcaklık mutlak sıfıra yaklaştıkça bütün hareketler sıfıra yaklaşır.
Sıcaklık mutlak sıfıra yaklaştıkça, bir sistemin entropisi bir sabite yaklaşır. Bu sayının sıfır değil de bir sabit olmasının sebebi, bütün hareketler durmasına ve buna bağlı olan belirsizliklerin yok olmasına rağmen kristal olmayan maddelerin moleküler dizilimlerinin farklı olmasından kaynaklanan bir belirsizliğin hala mevcut olmasıdır. Ayrıca üçüncü yasa sayesinde maddelerin mutlak sıfırdaki entropileri referans alınmak üzere kimyasal tepkimelerin incelenmesinde çok yararlı olan mutlak entropi tanımlanabilir.
Bu yasalardan birini ihlal eden makinalara o yasanın numarası türünden (örneğin, yoktan enerji yaratıyorsa birinci türden) devridaim makinası (ilginç bir şekilde Türkçe’de “Con Ahmet Makinası”) denir.
Termodinamiğin kanunlarını anlatmaya çalıştığımız yazımızı okuduğunuz için teşekkürler. Termodinamik Nedir? Temel Termodinamik bilgileri hakkında yazılarımızı da okumanızı öneririz.